医療法人社団ベスリ会の論文が令和5年6月25日付けで雑誌「Vaccines」に掲載されました。

詳しくはこちらをお読みください。
簡単にではありますが論文内容をご説明させていただきます。
【研究概要】
※この研究では以下の通り定義しました。
コロナ後遺症群群;新型コロナウイルス感染症後(SARS-CoV-2)に、長期間続くうつ病、集中力の低下、不安、睡眠障害、倦怠感など、の精神的/身体的症状を訴えた外来患者
コロナワクチン副反応;新型コロナウイルス感染症ワクチン接種後に、長期間続くうつ病、集中力低下、不安、睡眠障害、倦怠感などの精神的/身体的症状を訴えた外来患者
※ワクチン接種は新型コロナウイルス感染症のパンデミックを防ぐために不可欠であり、この論文はワクチン接種を否定するものではありません。
はじめに
コロナウイルス感染症(COVID-19)のパンデミックは猛威を振るっており、依然として世界中で最も重大な公衆衛生問題となっています。
Long-COVIDの症状は多様で、抑うつ症状、集中力の低下、不安、睡眠障害、倦怠感などの精神症状と身体症状があり、回復後の患者の日常生活が困難になります※1,2,3,4,5
にもかかわらず、長期コロナウイルスに対する効果的な治療法はまだ特定されておらず、さまざまな選択肢が模索されています。
また、ワクチン接種は新型コロナウイルス感染症のパンデミックを防ぐために不可欠であり、世界中で大規模に実施されています。発生率は非常に低いですが、コロナワクチンによる長期的な副作用も報告されています。加えて、コロナ後遺症症状がコロナワクチン副反応に似ていることを示唆する報告も増えています※11,12。
しかし、コロナ後遺症やコロナワクチン副反応に対する効果的な治療法に関する報告は多くありません。
当院では2020年5月以降主に抑うつ状態、不安障害、睡眠障害に対しTMS治療を行ってきました。2021年1月以降、コロナ後遺症・コロナワクチン副反応を原因と訴える患者が増加しました。そこで、以下のような臨床的経験則を得ました。
1,コロナワクチン副反応はコロナ後遺症症状に似ている
2,コロナ後遺症やコロナワクチン副反応を原因と訴える抑うつ状態、不安障害、睡眠障害に対するTMS治療の効果がみとめられる。
3,疲労症状が強いほど改善しにくい
そこで私たちはコロナ後遺症群とコロナワクチン副反応群の医療記録を詳細に後ろ向き解析し、以下のことを検証しました。
1,コロナ後遺症患者とコロナワクチン副反応患者の抑うつ状態に対するTMS治療の有効性
2,コロナ後遺症症状とコロナワクチン副反応の違い
3,コロナ後遺症群やコロナワクチン副反応群の患者におけるTMS治療による改善率と疲労症状の関係性
各種心理検査
・抑うつ状態の指標;QIDS(Quick Inventory of Depressive Symptomatology)※32
・抑うつ状態の指標;PHQ9(Patient Health Questionnaire-9)※33
・不安障害の指標;GAD7(Generalised anxiety disorder-7)※34
・疲労症状の指標;PS(Performance Status)※35,36
※PS;筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)の診断基準に基づいて厚生労働省が定めた要件に基づいて作成された基準

TMS治療により心理検査数値の改善
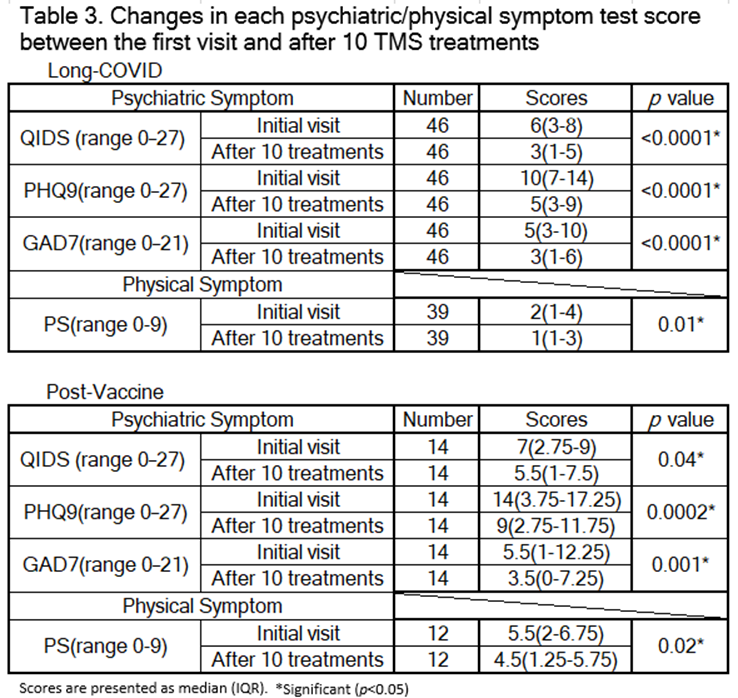
① コロナ後遺症群・コロナワクチン副反応群共にTMS治療前に比べ有意にTMS治療後のスコアが改善した。
両群のTMS治療前後の心理検査結果(QIDS、PHQ9、GAD7、PS)を比較すると、すべての項目が有意に改善しました。
今回は後ろ向き前後比較研究ではありましたが、TMS治療がQIDS、PHQ9、GAD7 を改善することを示唆する報告が数多くあります。
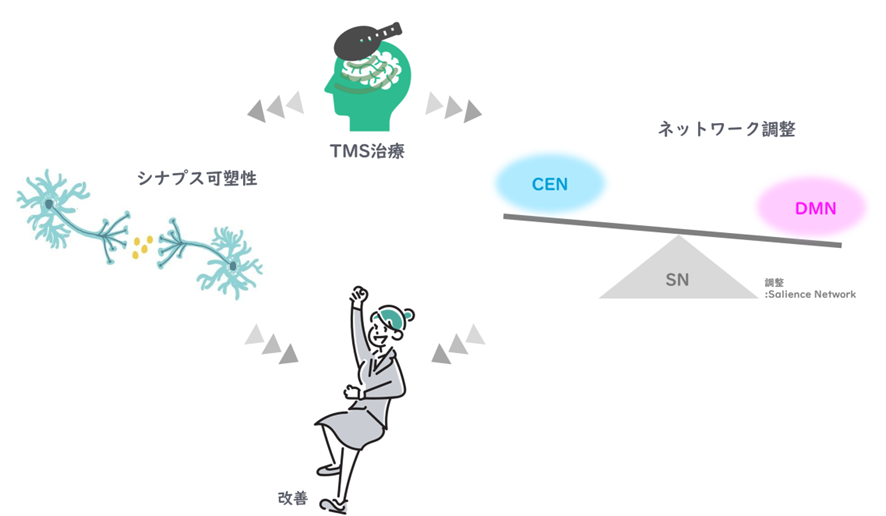
TMSでDLPFC(背外側前頭前野)を刺激すると、活動低下領域にシナプス可塑性が誘導され、うつ病や不安が改善されることが示されています。※39,40,41,42
うつ病患者を対象とした多くの研究では、DLPFCや前帯状皮質などの重要な感情コントロールと、大規模ネットワーク間の機能的接続におけるTMS治療による有意な変化が示されています。※43
したがって、QIDS、PHQ9、および GAD7 スコアの改善は TMS によるものであると考えられます。
もっと詳しく!
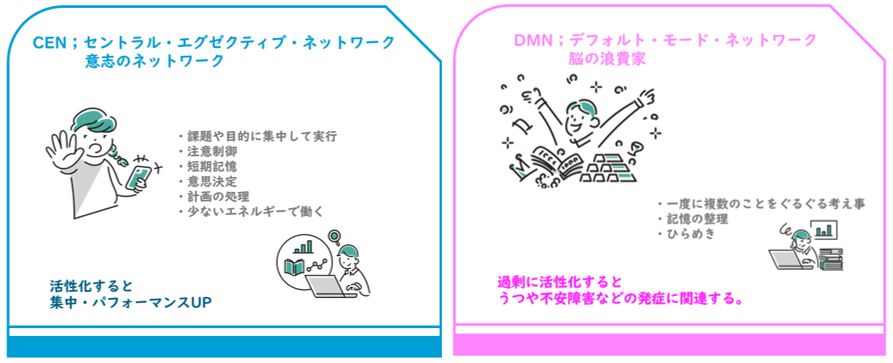
✔ シナプス可塑性・大規模ネットワークとは
コロナ後遺症とコロナワクチン副反応は似ている?
②コロナ後遺症患者とコロナワクチン副反応患者の発症メカニズムには多くの共通点がある
コロナ後遺症・コロナワクチン副反応の両グループの背景因子・初診時心理検査数値・治療経過の全てにおいて差はみられませんでした [Table2][Table4]。
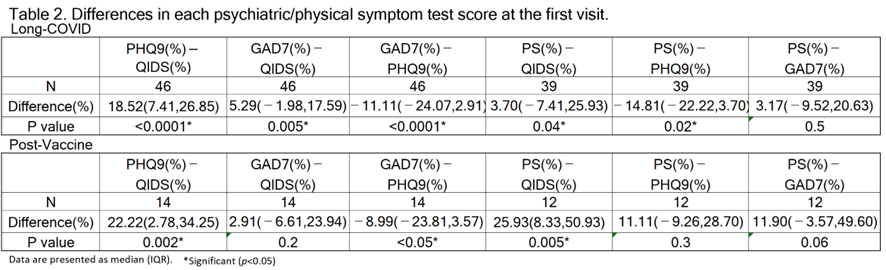
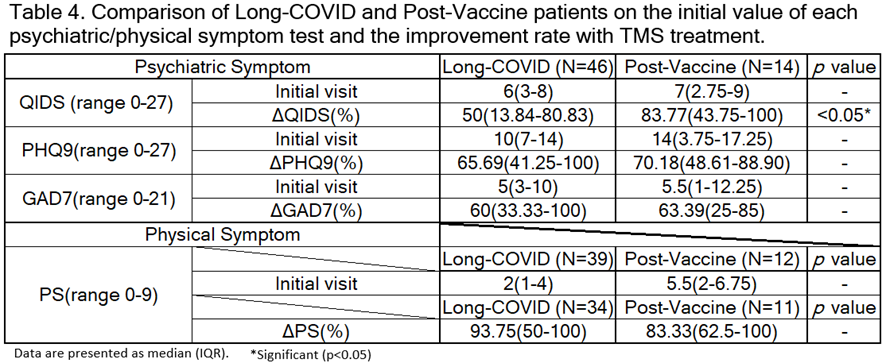
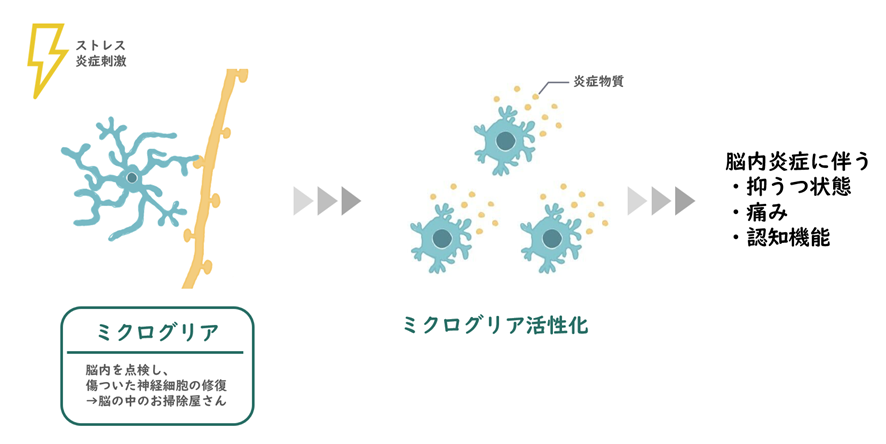
差がないということだけで同じであると断定することはできませんが、COVID-19は重度の炎症症状を引き起こすことが報告されており、軽度の感染であっても長期間持続するサイトカインの上昇と脳内でのミクログリアの活性化に関連しています。※27
対照的に、日本で流通しているmRNAワクチン(mRNA-1273 SARS-CoV-2ワクチンおよびBNT162b2 mRNA COVID-19ワクチン※44,45])を含む新型コロナワクチンは、低率ではありますがコロナ後遺症様の症状を引き起こすことが知られております。※11 報告によると、新型コロナワクチンは、自然免疫系の破壊、IFN-αシグナル伝達の抑制、細胞内の悪性化の予防と検出の失敗、スパイク糖タンパク質を運ぶ大量のエクソソームの生成により、低率ではありますが重度の炎症症状を引き起こす可能性が示されています。※12
以上より、広範囲にわたる炎症が、コロナ後遺症とコロナワクチン副反応双方の発症メカニズムに関与していると推測できます。
疲労症状が強いほど改善しにくい
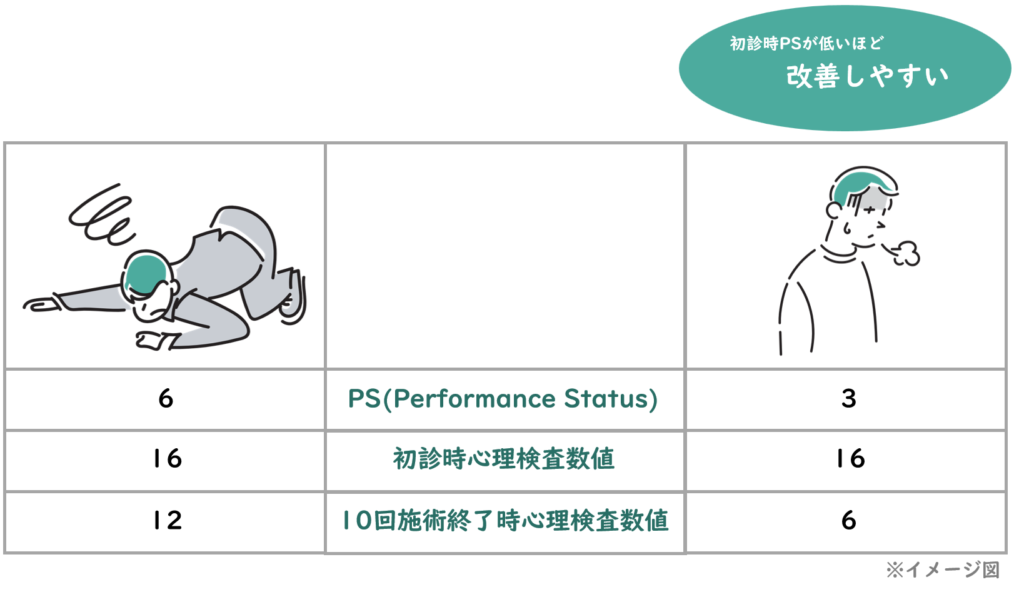
③慢性疲労症状が強い患者(PSが高い患者)ほど、心理検査の改善率が良くない(回復しにくい)
初期診断時のPS(慢性疲労症候群診断の参照尺度として使用される検査)が高いほど、QIDSの改善率が良くない(回復しにくい)ことがわかりました。[Figure3]
今回の調査結果は我々の臨床経験則と一致しており、慢性疲労状態が新型コロナウイルス関連のうつ病からの回復に影響を与える可能性があることを示しています。

慢性疲労と新型コロナウイルス関連うつ病との関連性は、両方の発症メカニズムの観点からも示されています。
慢性疲労症候群患者は、健康な被験者よりも酸化ストレスのレベルが高く、脳内でのミクログリアの活性化がより広範囲でみられました※24,25。
興味深いことに、慢性疲労症候群患者におけるミクログリアの活性化レベルは、認知障害、うつ病や痛みの重症度と正の相関関係がありました。
COVID-19で死亡した患者の解剖報告では、脳内でのSARS-CoV-2感染が確認されなかったにもかかわらず、脳内のミクログリアの活性化が報告されています※26。
肺に限定された SARS-CoV-2 感染症を患うマウスの実験研究でも、白質におけるミクログリアの活性化が明らかになりました※27。
最近の研究では、Long-Covid患者は健康な被験者よりも高い酸化ストレスにさらされていることが判明しました※28。
これらの発見は、脳内のミクログリアの活性化と酸化ストレスの増加がME/CFS および Long-Covidを引き起こすことを示唆しています。
PSレベルが高い患者の脳内炎症と高い酸化ストレスは、TMS 治療に対する抵抗性に関連している可能性があります。
このような患者において炎症と酸化ストレスの制御は、TMSによるコロナ後遺症・ワクチン副反応を原因とするうつ病からの回復に必要であると考えられます※29。
参考文献
クリックで原文に飛べます
1, Efstathiou, V.; Stefanou, M.I.; Demetriou, M.; Siafakas, N.; Makris, M.; Tsivgoulis, G.; Zoumpourlis, V.; Kympouropoulos, S.P.; Tsoporis, J.N.; Spandidos, D.A.; et al. Long COVID and neuropsychiatric manifestations (Review). Exp. Ther. Med. 2022, 23, 363.[Pub Med]
2, Schou, T.M.; Joca, S.; Wegener, G.; Bay-Richter, C. Psychiatric and neuropsychiatric sequelae of COVID-19—A systematic review. Brain Behav. Immun. 2021, 97, 328–348[Pub Med]
3, Bourmistrova, N.W.; Solomon, T.; Braude, P.; Strawbridge, R.; Carter, B. Long-term effects of COVID-19 on mental health: A systematic review. J. Affect. Disord. 2022, 299, 118–125.[Google scholor]
4, Thompson, E.J.; Stafford, J.; Moltrecht, B.; Huggins, C.F.; Kwong, A.S.; Shaw, R.J.; Zaninotto, P.; Patel, K.; Silverwood, R.J.; McElroy, E. Psychological distress, depression, anxiety, and life satisfaction following COVID-19 infection: Evidence from 11 UK longitudinal population studies. Lancet Psychiatry 2022, 9, 894–906.[Pub Med]
5, Mazza, M.G.; Palladini, M.; Poletti, S.; Benedetti, F. Post-COVID-19 Depressive Symptoms: Epidemiology, Pathophysiology, and Pharmacological Treatment. CNS Drugs 2022, 36, 681–702.[Pub Med]
11, Couzin-Frankel, J.; Vogel, G. Vaccines may cause rare, Long Covid-like symptoms. Science 2022, 375, 364–366.[Pub Med]
12, Seneff, S.; Nigh, G.; Kyriakopoulos, A.M.; McCullough, P.A. Innate immune suppression by SARS-CoV-2 mRNA vaccinations: The role of G-quadruplexes, exosomes, and MicroRNAs. Food Chem. Toxicol. 2022, 164, 113008.[Pub Med]
24, Nakatomi, Y.; Mizuno, K.; Ishii, A.; Wada, Y.; Tanaka, M.; Tazawa, S.; Onoe, K.; Fukuda, S.; Kawabe, J.; Takahashi, K.; et al. Neuroinflammation in Patients with Chronic Fatigue Syndrome/Myalgic Encephalomyelitis: An (1)(1)C-(R)-PK11195 PET Study. J. Nucl. Med. 2014, 55, 945–950.[Pub Med]
25, Jammes, Y.; Steinberg, J.G.; Delliaux, S. Chronic fatigue syndrome: Acute infection and history of physical activity affect resting levels and response to exercise of plasma oxidant/antioxidant status and heat shock proteins. J. Intern. Med. 2012, 272, 74–84.[Pub Med]
26, Matschke, J.; Lutgehetmann, M.; Hagel, C.; Sperhake, J.P.; Schroder, A.S.; Edler, C.; Mushumba, H.; Fitzek, A.; Allweiss, L.; Dandri, M.; et al. Neuropathology of patients with COVID-19 in Germany: A post-mortem case series. Lancet Neurol. 2020, 19, 919–929.[Pub Med]
27, Fernandez-Castaneda, A.; Lu, P.; Geraghty, A.C.; Song, E.; Lee, M.H.; Wood, J.; O’Dea, M.R.; Dutton, S.; Shamardani, K.; Nwangwu, K.; et al. Mild respiratory COVID can cause multi-lineage neural cell and myelin dysregulation. Cell 2022, 185, 2452–2468.e16.[Pub Med]
28, Al-Hakeim, H.K.; Al-Rubaye, H.T.; Al-Hadrawi, D.S.; Almulla, A.F.; Maes, M. Long-COVID post-viral chronic fatigue and affective symptoms are associated with oxidative damage, lowered antioxidant defenses and inflammation: A proof of concept and mechanism study. Mol. Psychiatry 2022.[Pub Med]
29, Wood, E.; Hall, K.H.; Tate, W. Role of mitochondria, oxidative stress and the response to antioxidants in myalgic encephalomyelitis/chronic fatigue syndrome: A possible approach to SARS-CoV-2 ‘long-haulers’? Chronic. Dis. Transl. Med. 2021, 7, 14–26.[Pub Med]
32, Rush, A.J.; Trivedi, M.H.; Ibrahim, H.M.; Carmody, T.J.; Arnow, B.; Klein, D.N.; Markowitz, J.C.; Ninan, P.T.; Kornstein, S.; Manber, R.; et al. The 16-Item Quick Inventory of Depressive Symptomatology (QIDS), clinician rating (QIDS-C), and self-report (QIDS-SR): A psychometric evaluation in patients with chronic major depression. Biol. Psychiatry 2003, 54, 573–583.[Pub Med]
33, Kroenke, K.; Spitzer, R.L.; Williams, J.B. The PHQ-9: Validity of a brief depression severity measure. J. Gen. Intern. Med. 2001, 16, 606–613.[Pub Med]
34, Spitzer, R.L.; Kroenke, K.; Williams, J.B.; Lowe, B. A brief measure for assessing generalized anxiety disorder: The GAD-7. Arch. Intern. Med. 2006, 166, 1092–1097.[Pub Med]
35, Beyond Myalgic Encephalomyelitis/Chronic Fatigue Syndrome: Redefining an Illness; The National Academies Collection; National Institutes of Health: Washington, DC, USA, 2015.[Pub Med]
36, Kuratsune, H. Diagnosis and Treatment of Myalgic Encephalomyelitis/Chronic Fatigue Syndrome. Brain Nerve 2018, 70, 11–18.[Pub Med]
39,Baeken, C.; De Raedt, R. Neurobiological mechanisms of repetitive transcranial magnetic stimulation on the underlying neurocircuitry in unipolar depression. Dialogues Clin. Neurosci. 2011, 13, 139–145.[Pub Med]
40, Kim, E.J.; Kim, W.R.; Chi, S.E.; Lee, K.H.; Park, E.H.; Chae, J.H.; Park, S.K.; Kim, H.T.; Choi, J.S. Repetitive transcranial magnetic stimulation protects hippocampal plasticity in an animal model of depression. Neurosci. Lett. 2006, 405, 79–83.[Pub Med]
41, Ressler, K.J.; Mayberg, H.S. Targeting abnormal neural circuits in mood and anxiety disorders: From the laboratory to the clinic. Nat. Neurosci. 2007, 10, 1116–1124.[Pub Med]
42, George, M.S.; Taylor, J.J. Theoretical basis for transcranial magnetic stimulation. In A Clinical Guide to Transcranial Magnetic Stimulation; Oxford University: Oxford, UK, 2014; pp. 1–7.[Google scholor]
43, Schiena, G.; Franco, G.; Boscutti, A.; Delvecchio, G.; Maggioni, E.; Brambilla, P. Connectivity changes in major depressive disorder after rTMS: A review of functional and structural connectivity data. Epidemiol. Psychiatr. Sci. 2021, 30, e59.[Google scholor]